O que é?
O átomo é a unidade básica da matéria que compõe todas as substâncias existentes. Você, por exemplo, é formado por átomos! A palavra vem do grego, que significa “sem partes” ou “indivisível”, porém hoje sabe-se que o átomo é composto por partículas subatômicas, que o caracterizam como uma estrutura divisível.
Estrutura dos átomos
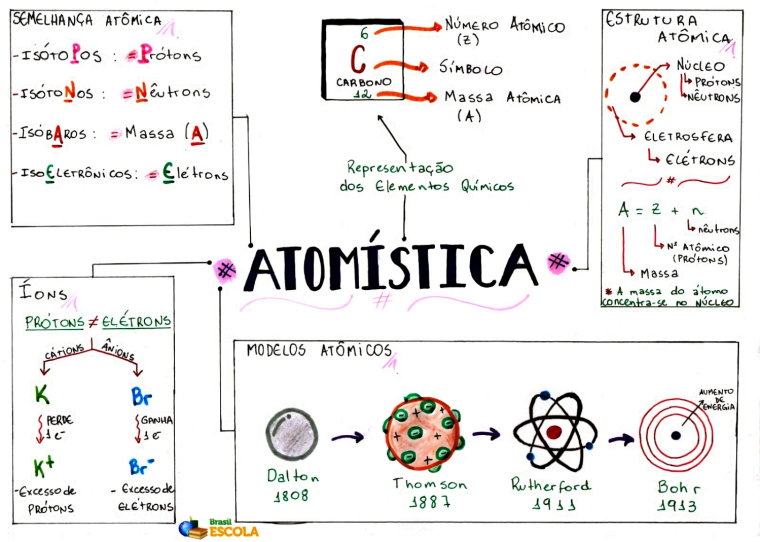
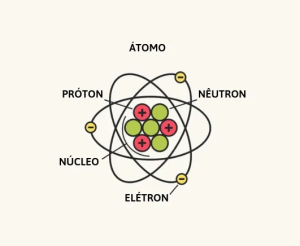
O modelo atual do átomo propõe que ele esteja dividido em duas regiões: o núcleo, onde estão concentradas as partículas positivas (prótons), e os nêutrons, que são partículas sem carga necessárias para dar estabilidade ao núcleo. E a outra parte é a eletrosfera, que é onde os elétrons orbitam ao redor do núcleo.
Baixe o mapa mental no grupo do Telegram!
Eletrosfera
O conceito de eletrosfera apareceu no ano de 1911, com o modelo atômico proposto por Rutherford, que disse que os elétrons giravam em órbitas ao redor do núcleo em espaços vazios, semelhante ao Sistema Solar.
A eletrosfera é dividida em 7 órbitas, que possuem uma quantidade de energia fixa, a qual aumenta proporcionalmente com sua distância do núcleo. Essas órbitas são denominadas K, L, M, N, O, P e Q, sendo a camada K a mais próxima do núcleo e, consequentemente, a de menor energia e a camada Q a mais distante e com maior energia.
Características dos átomos
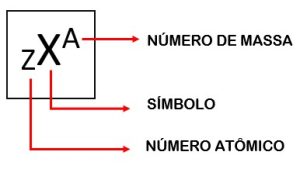
Número atômico (Z)
Indica a quantidade de prótons que o átomo possui em seu núcleo. É o número atômico que diferencia os átomos entre si, já que cada átomo possui uma quantidade de prótons diferente.
Número de massa (A)
O número de massa de um átomo é calculado com base na soma da quantidade de prótons e nêutrons presentes no seu núcleo. A massa dos elétrons é desprezível em relação à massa dos prótons e nêutrons, por isso podemos afirmar que a massa do átomo está concentrada no núcleo.
A fórmula para calcular o número de massa de um átomo é:
A = Z + n ou A = p + n
Onde,
p = nº de prótons;
n = nº de nêutrons;
Z = número atômico.
Semelhança de átomos
Ao comparar dois átomos, podemos encontrar algumas semelhanças nas quantidades de partículas subatômicas presentes em suas estruturas ou ainda na sua massa. Para cada tipo de semelhança, temos uma classificação:
Isótopos
É a denominação de átomos que apresentam o mesmo número de prótons (p), ou seja, possuem o mesmo número atômico (Z).
Como a quantidade de prótons e a quantidade de elétrons são iguais para átomos neutros, os átomos isótopos terão também o mesmo número de elétrons quando não estivermos comparando átomos neutros e íons.
Isótonos
É a denominação de átomos que possuem a mesma quantidade de nêutrons no núcleo.
Isóbaros
É a denominação de átomos que possuem semelhança no número da massa.
Isoeletrônicos
É a denominação de quando duas espécies químicas (átomos ou íons) apresentam o mesmo número de elétrons. No caso dos íons, deve-se levar em conta sua carga para identificar a quantidade de elétrons.
Confira outras coisas que podem te interessar:
Humanismo: o que estudar para o Enem?
O que você precisa saber sobre português
Referência da capa: https://studymaps.com.br/atomistica/